pISSN : 3058-423X eISSN: 3058-4302
Open Access, Peer-reviewed
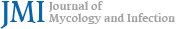
pISSN : 3058-423X eISSN: 3058-4302
Open Access, Peer-reviewed
Youngwoo Seo,Joonsoo Park,Taechang Jang
http://dx.doi.org/10.17966/KJMM.2016.21.1.14 Epub 2016 April 07
Abstract
Mucormycosis is a highly aggressive and fatal fungal infection. Due to its rapid progression, combination of early wide surgical debridement with administration of antifungal agent is extremely crucial. European Society for Clinical Microbiology and Infectious Diseases, and European Confedration of Medical Mycology recommended amphotericin B as the first-line of treatment and posaconazole as the salvage agent for mucormycosis. We report a case of rhino-orbital-cerebral mucormycosis successfully treated by changing antifungal agent from the first-line amphotericin B to the salvage agent posaconazole. A 57-years-old female with uncontrolled type 2 diabetes mellitus was presented with foot abscess and rhino-orbital-cerebral mucormycosis. The infection was intractable despite orbital orbital exenteration with surgical debridement and 2 months of antibiotics treatment including amphotericin B. Changing amphotericin B to posaconazole resulted in clinical improvement within the first week. Conclusively the newly administered antifungal agent, posaconazole is expected to be an effective salvage treatment option for mucormycosis after failure of initial treatment of amphotericin B with surgical management.
Keywords
Mucormycosis Posaconazole Salvage treatment Surgical treatment
서 론
털곰팡이증 (mucormycosis)은 연간 백만명당 0.4~1.7명이 발생[1],[2]하는 흔하지 않은 진균감염으로 진행이 매우 빠르고 치명적이고 응급을 요하는 감염증으로 초기의 적절한 치료가 환자의 예후에 매우 중요하다[3],[4]. 당뇨병은 털곰팡이증의 가장 중요한 위험인자이며, 털곰팡이증의 아형 가운데 비안와뇌 (rhino-orbital-cerebral)형이 가장 흔하다[5],[6]. 조절되지 않은 당뇨병, 특히 케톤산증을 동반한 경우, 혈액종양, 장기간 면역 억제제 사용 등 환자의 면역 체계에 장애가 있을 때 흔히 발생한다[7].
털곰팡이증의 진단은 진균감염을 조직병리학적으로 증명하는 것이 중요하며, 병변 부위 조직이나 흡인 검체에서 균사가 넓고 격막이 없으며 이분지 모양으로 수직 분지하는 것이 특징이다[8]. 하지만 털곰팡이의 배양률이 매우 낮아 수술적 절제, 세침흡인 등의 방법으로 조직검사를 시행하여 털곰팡이의 균사를 확인하는 것이 필요하다[9].
2014년 유럽 임상미생물학감염병학회와 유럽의학진균학회에서 공동 발표한 털곰팡이증의 진단과 치료 지침에 따르면 털곰팡이증의 치료는 외과적 죽은조직절제술와 항진균제를 사용하는 것이고 면역억제 환자의 경우 liposomal amphotericin B의 사용이 추천되고 있으며, posaconazole 또한 추천되는 구제 치료 (salvage treatment)이다[10]. 하지만 국내에서 수술적 요법과 함께 amphotericin B 치료 이후 구제 치료로 posaconazole 사용으로 치료에 성공한 경우는 매우 드물다.
이에 본 저자들은 당뇨병성 케톤성 산증 의증환자에서 발생한 비안와뇌형의 털곰팡이증 환자를 안와내용물제거술 (orbital exenteration) 수술과 함께 amphotericin B 치료를 시도하였으나 실패하고 posaconazole 구제 치료로 완치하였기에 문헌 고찰과 함께 보고하고자 한다.
증 례
환 자: 문OO, 57세, 여자
주 소: 3일간의 좌측 눈주위 통증
현병력: 고혈압, 고콜레스테롤혈증, 지방간, 당뇨병을 앓고 있는 환자로 1개월 전에 우측발 부위를 소에게 밟힌 이후 우측발 부종이 있었으나 특별한 검사나 치료는 받지 않으며 지냈다. 2주전부터 자가 측정 혈당이 300~500 mg/dL으로 오르면서 타 병원에서 조절을 시도하였으나 계속400~500 mg/dL 측정되었다. 내원 3일 전부터는 좌측 눈주위 통증, 오한감 동반되어 본원 응급의료센터로 내원하였다.
과거력: 10년 전부터 고혈압, 2년 전부터 고콜레스테롤혈증, 지방간, 당뇨병으로 경구약 복용중.
가족력: 특이 사항 없음.
피부 소견: 좌측 눈주위 부종 (Fig. 1)과 우측발에 홍반을 동반한 부종
이학적 소견: 피부 소견 외에 특이 소견 없음.
검사 소견: 일반혈액검사상 적혈구침강속도 29mm/hr, 아스파르테이트아미노전달효소 65 IU/L로 증가되어 있었다. 동맥혈 가스 분석 검사상pH 7.509, 이산화탄소분압 23.5 mmHg, 중탄산염 18.3 mEq/L, 혈당 425 mg/dL, 혈청과 소변에서 케톤 양성 소견을 보였다. 그 외 일반혈액검사와 흉부 X선상 특이 소견은 없었다.
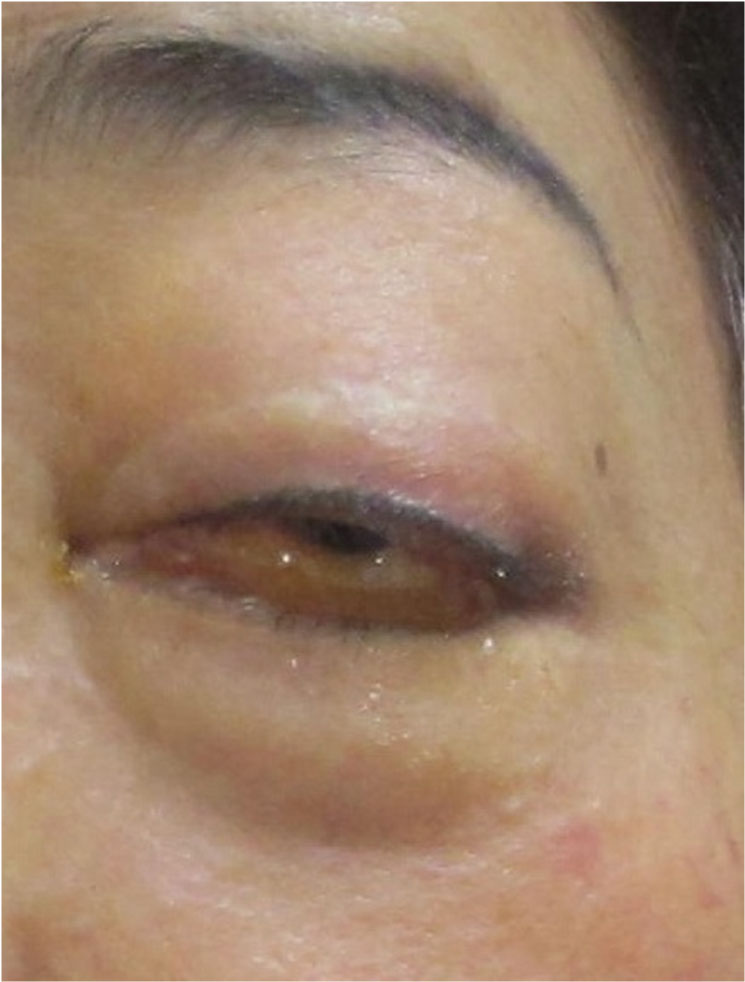
병리조직학적 소견: 좌측 눈주위에서 시행한 병리조직검사 상 H&E 염색에서 진피층에 격막이 없는 넓은 폭을 가진 균사가 관찰되었고, 진피 전반에 광범위한 염증 세포의 침윤이 관찰되었다 (Fig. 2A). GMS 염색에서 직각을 이루며 분사하는 균사체가 명확하게 관찰되었다 (Fig. 2B).
진균검사 소견: 3개의 사브로 한천 배지(Sabouraud's agar medium)를 이용하여 37℃에서 배양하였다. 그 중 2개의 배지에서 배양 2일째에 흰색의 솜털 같은 양상의 집락들을 형성하기 시작하였다. 그 후 1개의 배지에서는 배양 4일째부터, 다른 하나의 배지에서는 배양 5일째부터 회색과 갈색으로 변하면서 집락들이 판 전체에서 자랐다. 이후 집락들을 채취하여 lactophenol cotton blue 염색 후 현미경으로 검안하였을 때 뿌리 (rhizoid)에서 직접 포자낭병 (sporangiophore)이 뻗어 나왔으며 포자낭 (sporangium)은 구모양으로 보였다.
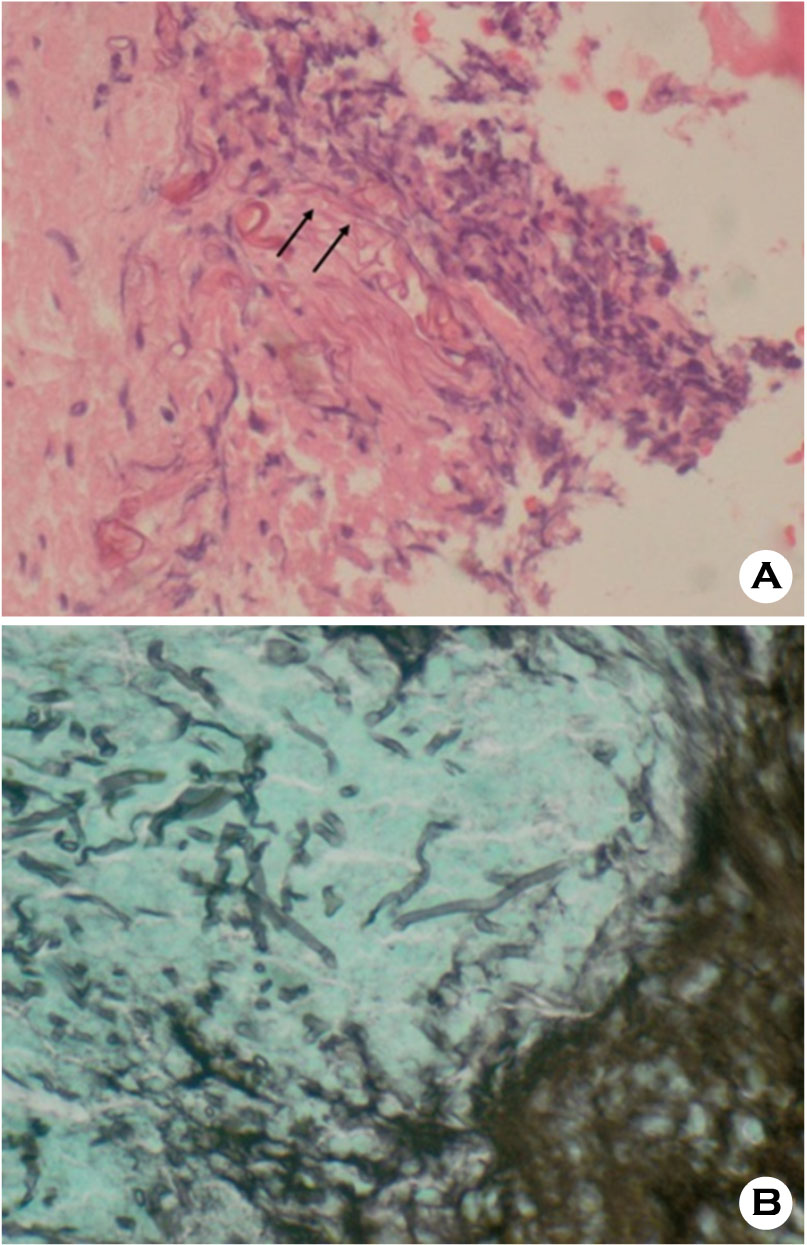
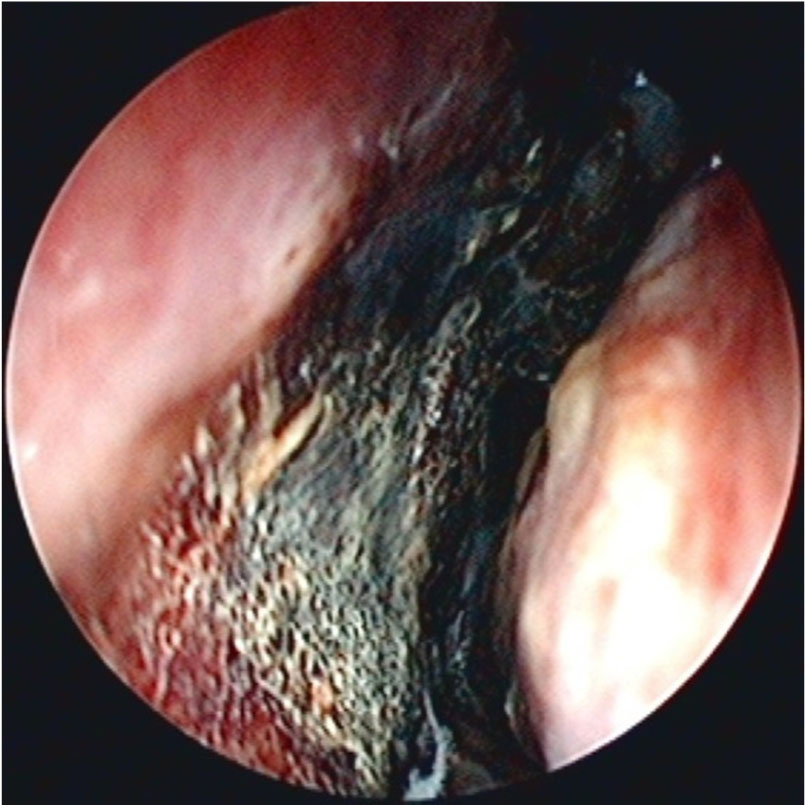
치료 및 경과: 검사실 소견상 당뇨병성 케톤성산증 의증하에 입원하여 상기 진단에 대한 치료하며 시행한 눈주위 자기공명영상 검사상 시각신 경집과 시신경관을 침범하는 안와지방침윤 등의 소견을 보였다 (Fig. 3). 이비인후과에서 실시한 비경 검사에서 비중격의 괴사 소견을 보였다 (Fig.4). 또한 우측발의 부종은 검사상 농양으로 진단되었다. 이에 털곰팡이증 의증으로 amphotericin B (60 mg)을 정주하고 우측발 농양으로 ceftriaxone(2 g/day)을 정주하고, 내원 4일째부터 vancomycin(2 g/day), metronidazole (1,500 mg/day)을 추가하였다.
내원 5일째 정형외과에서 우측발의 농양에 대한 절개배농술을 시행하였다. 이후 6일째 안과와 이비인후과의 협진 하에 안와내용물제거술(orbital exenteration), 상악동의 광범위 죽은조직제거술과 안면부의 조직생검을 시행하였다. 수술 시행한 생검 조직으로 시행한 진균검사 소견은위와 같았다.
15일째 고열이 있어 다음 날부터 amphotericin B와 ceftriaxone을 중지하고 liposomal amphotericin B (300 mg/day) 정주를 시작하였다. 18일째부터 vancomycin과 metronidazole을 중지하고 piperacillin-tazobactam (9 mg/day)을 시작하였다. Liposomal amphotericin B 정주 후 산증 등의 부작용이 지속되고 상태 호전이 없어 구제 치료로 posaconazole(800 mg/day)을 처방하였다. 대체 치료 1주일 동안 특별한 부작용은 발생하지 않았으며 상태 호전되어 입원 70일 만에 퇴원하였다.
고 찰
털곰팡이증은 혈관 침윤성 질환으로 특히 면역 저하 환자에게서 급성 발병과 치명적인 경과를 보인다[4]. 사망 전의 진단이 어려워 정확한 유병률은 알려지지 않았지만, 검사기법이 발달하고 면역력 저하와 관련된 질병을 가진 환자의 생존이 길어지는 등으로 진단률과 유병률이 증가하고 있다[1],[11]. 하지만 아직까지 임상적, 검사실적 진단의 어려움이 많아 높은 사망률을 보인다.
털곰팡이증의 원인 진균으로는 Rhizopus속 (genus), Mucor속, Lichtheimia속 등이 흔하며 전체 털곰팡이증 중 70~80%를 차지한다[4]. 감염의 위험인자로는 당뇨병 (당뇨병성 케톤산증), 혈액종양, 장기간의 면역 억제제 사용, 만성신부전 등이 있다[7],[12].
털곰팡이증 임상양상으로는 비안와뇌형이 가장 많고, 폐나 위장관의 감염, 여러 장기를 침범하는 파종형, 국소적 피부감염 등으로도 나타날 수 있다. 증상과 징후로는 열 (44%), 비간의 궤양이나 괴사 (35%), 눈주위나 얼굴의 부종 (34%), 시력저하 (30%), 안근마비 (29%), 두통 (25%), 안구통(22%), 정신상태의 저하 (22%) 등이 있다[13]. 컴퓨터단층촬영과 자기공명영상 검사상 부비동, 상악동 내의 연부조직 비후의 소견을 보일 수 있다[13]. 털곰팡이증이 의심될 경우 조직병리학적으로 확진을 시행하여야 하며, 현미경 검사상 격막이 없거나 파우 시 격막 (pauci-septate)을 보이며, 불규칙하며 리본과 같은 모양의 균사가 45~90° 각도로 분사하며 그 굵기는 6 μm에서 16 μm 이상까지도 관찰될 수 있다[8],[10],[13]. 진균배양검사는 사브로 한천 배지를 이용하여 배양을 한다. 배양 시 1~7일만에 판 전체로 빠르게 자라며 Rhizopus의 경우 현미경 검안 시에 뿌리에서 포자낭병이 직접 뻗어나와 구모양의 포자낭을 보인다[14].
본 증례 환자의 경우에도 혈당조절에 실패한 당뇨병 환자로 열, 눈주위 부종, 안구통 등의 심하지 않은 증상으로 응급의료센터로 내원하였다. 영상의학적 검사상 시각신경집과 시신경관을 침범하는 눈주위지방침윤과 부비동염의 소견을 보였다. 이비인후과 검사에서 비중격 괴사 소견이 보이고 안과 검사에서 진균감염이 의심되었다. 이에 털곰팡이증 의증 하에 amphotericin B 정주를 시작하고 안와내용물제거술, 상악동 주변의 광범위 죽은조직제거술과 안면부의 조직생검을 시행하였으며 진균배양검사와 병리조직학적검사 소견상 Rhizopus에 의한 털곰팡이증에 합당한 소견을 보였다.
일반적인 털곰팡이증은 amphotericin B로 치료한 경우 61%, 수술적 치료만 시행한 경우 57%, 수술적 치료와 항진균제 병행 치료의 경우 70%의 높은 생존률을 보였다[4]. 비안와뇌형 털곰팡이 증에서 항진균제 단독요법 시 70%의 사망률을 보였고, 수술적 치료와 항진균제 치료를 병행한 경우 14%의 사망률을 보여 수술적 치료를 병행하는 것이 훨씬 치료 효과가 우수했다[15]. 다른 연구에서도 털곰팡이증의 치료로 수술적 치료와 항진균요법의 병행을 추천하고 있다[4],[10],[15]. 수술 방법으로는 비안와뇌형의 경우 안와내용물제거술을 포함하여 주위 침범 조직의 광범위한 죽은조직제거술을 시행하도록 추천하고 있다[10],[16]. 하지만 안와내용물제거술 시에는 환자의 삶의 질과 기능적 손상 등에 대해서 생각해 보아야 하며, 환자가 생존한 이후에 재건을 고려할 수 있다[16].
항진균제로는 amphotericin B가 1차 치료로 추천되며, 다른 치료로 amphotericin B와 caspofungin의 병합요법, posaconzole 등이 있다[5],[10]. 항진균제의 치료기간은 개별 환자의 경과에 따라 결정하도록 되어 있으며 치료 실패 시 다른 약제로 대체 혹은 병합요법을 추천한다[10].
추가적인 치료들로는 혈당이 조절되지 않은 당뇨병 환자의 경우에는 고혈당을 조절하고 케톤성 산증을 교정해주어야 하고 혈당조절을 위해 GM-CSF를 고려해볼 수 있으며, 비안와뇌 침범이 있는 당뇨병 환자의 경우에는 수술을 강력히 고려해야 하고, 장기간 스테로이드를 복용 중인 환자는 최소한의 용량으로 줄이거나 복용을 중단하여야 한다[10]. 100% 고압산소요법이 고려될 수 있으나 아직 치료 효과는 명확하지 않고, 실험실 연구에서 lovastatin이 Rhizomucor pusillus의 성장을 막는 것으로 나타났으나 치료 효과는 아직 입증되지 않았다[10].
본 증례에서는 고혈당과 케톤성 산증을 교정하며 수술적 치료를 시행하였다. 그리고 털곰팡이증 외에도 우측발의 농양도 있어 항생제도 같이 사용하였다. 항진균제로는 amphotericin B 선택하여 치료하였으나 부작용이 지속되고 치료에 반응이 미미하여 posaconazole로 대체하여 치료하였다. Posaconazole로 변경 후 특별한 부작용은 없었으며 치료에도 반응이 좋았다.
곰팡이증의 치료로는 amphotericin B와 수술 병행요법이 표준요법으로 추천되고 있다. Posaconazole은 사상균과 효모균에 효과를 보이는 2세대 아졸계 항진균제로[5],[17] 최근에는 amphotericin B를 대신하거나 치료 실패 시 2차 항진균제로서 치료 효과가 점차 입증되고 있으며 구제 치료로 추천되고 있다[10],[18]. 국내에도 수술적 치료 없이 amphotericin B 치료 실패 후 posaconazole 대체 사용 후 완치된 사례보고도 있다[19]. 또 다른 국내의 연구에서 posaconazole을 털곰팡이증 등과 같은 침습적 진균감염병 환자에게 사용하여 55% (11명의 환자 중 6명)의 환자가 생존한 보고도 있다[20]. 따라서 비안와뇌형 털곰팡이증은 흔하지 않을 뿐만 아니라 생존률이 낮기 때문에 초기에 의심하고 진단하는 것이 중요하며, 수술적인 치료와 항진균요법 병합요법으로 치료함에 있어 posaconazole이 amphotericin B와 함께 적절한 대체 항진균제로 고려될 수 있으나 더욱 연구가 필요 할 것으로 보인다.
Conflict of interest
The authors declare no conflict of interest.
References
1. Bitar D, Cauteren DV, Lanternier F, Dannaoui E, Che D, Dromer F, et al. Increasing incidence of zygomycosis (mucormycosis), France, 1997-2006. Emerg Infect Dis 2009;15:1395-1401
Google Scholar
2. Rees JR, Pinner RW, Hajjeh RA, Brandt ME, Reingold AL. The epidemiological features of invasive mycotic infections in the San Francisco Bay area, 1992-1993: results of population-based laboratory active surveillance. Clin Infect Dis 1998;27:1138-1147
Crossref
Google Scholar
3. Fanfair RN, Benedict K, Bos J, Bennet SD, Lo YC, Adebanjo T, et al. Necrotizing cutaneous mucormycosis after a tornado in Joplin, Missouri, in 2011. N Engl J Med 2012;367:2214-2225
Crossref
Google Scholar
4. Roden MM, Zaoutis TE, Buchanan WL, Knudsen TA, Sarkisova TA, Schaufele RL, et al. Epidemiology and outcome of zygomycosis: a review of 929 reported cases. Clin Infect Dis 2005;41:634-653
Crossref
Google Scholar
5. Langner S, Staber PB, Neumeister P. Posaconazole in the management of refractory invasive fungal infections. Ther Clin Risk Manag 2008;4:747-758
Google Scholar
6. Pinto ME, Manrique HA, Guevara X, Acosta M, Villena JE, Solis J. Hyperglycemic hyperosmolar state and rhino-orbital mucormycosis. Diabetes Res Clin Pract 2011;91:e37-39
Google Scholar
7. Artis WM, Fountain JA, Delcher HK, Jones HE. A mechanism of susceptibility to mucormycosis in diabetic ketoacidosis: transferrin and iron availability. Diabetes 1982;31:1109-1114
Crossref
Google Scholar
8. Medoff G, Kobayashi GS. Pulmonary mucormycosis. N Engl J Med 1972;286:86-87
Crossref
Google Scholar
9. Tedder M, Spratt JA, Anstadt MP, Hegde SS, Tedder SD, Lowe JE. Pulmonary mucormycosis: results of medical and surgical therapy. Ann Thorac Surg 1994; 57:1044-1050
Crossref
Google Scholar
10. Cornely OA, Arikan-Akdagli S, Dannaoui E, Groll AH, Lagrou K, Chakrabarti A, et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of mucormycosis 2013. Clin MicrobiolInfect 2014;20:5-26
11. Gomes MZ, Lewis RE, Kontoyianis DP. Mucormycosis caused by unusual mycormycetes, non- Rhizopus, -Mucor, and -Lichtheimia species. Clini Microbiol Rev 2011;24:411-445
Crossref
Google Scholar
12. Kursun E, Turunc T, Demiroglu ZY, Aliskan HE, Arslan AH. Evaluation of 28 cases of mucormycosis. Mycoses 2015;58:82-87
Crossref
Google Scholar
13. Yohai RA, Bullock JD, Aziz AA, Markert RJ. Survival factors in rhino-orbital-cerebral mycormycosis. Surv Ophthalmol 1994;39:3-22
Crossref
Google Scholar
14. Lass-Florl. Zygomycosis: conventional laboratory diagnosis. Clin Microbiol Infect 2009;15 Suppl 5: 60-65
Crossref
Google Scholar
15. Talmi YP, Goldschmied-Reouven A, Bakon M, Barshack I, Wolf M, Horowitz Z, et al. Rhino-orbital and rhino-orbito-cerebral mucormycosis. Otolaryngol Head Neck Surg 2002;127:22-31
Crossref
Google Scholar
16. Rapidis AD. Orbitomaxillary mucormycosis (zygomycosis) and the surgical approach to treatment: perspectives from a maxillofacial surgeon. Clin Microbiol Infect 2009;15:98-102
Crossref
Google Scholar
17. Mullane K, Toor AA, Kalnicky C, Rodriguez T, Klein J, Stiff P. Posaconazole salvage therapy allows successful allogeneic hematopoietic stem cell transplantation in patients with refractory invasive mold infections. Transpl Infect Dis 2007;9:89-96
Crossref
Google Scholar
18. Ruping MJ, Heinz WJ, Kindo AJ, Rickerts V, Lass- Florl C, Beisel C, et al. Forty-one recent cases of invasive zygomycosis from a global clinical registry. J Antimicrob Chemother 2010;65:296-302
Crossref
Google Scholar
19. Kim WJ, Han SY, Nam YH, Kim JM, Ahn HE, Kim SJ, et al. A case report of successful posaconazole salvage therapy for rhinocerebral mucormycosis after failure of amphotericin B. Korean J Med 2010;79: 587-591
Google Scholar
20. Lee HJ, Kwon JC, Kim SH, Choi SM, Lee DG, Park SH, et al. Posaconazole trearment in Korea: singlecenter experience over 5 years. Yonsei Med J 2013; 54:1234-1240
Crossref
Google Scholar