pISSN : 3058-423X eISSN: 3058-4302
Open Access, Peer-reviewed
pISSN : 3058-423X eISSN: 3058-4302
Open Access, Peer-reviewed
Won Joo Kwon,Min Seok Kim,Eun Byul Cho,Eun Joo Park,Kwang Ho Kim,Kwang Joong Kim
http://dx.doi.org/10.17966/KJMM.2016.21.3.65 Epub 2016 October 03
Abstract
Background: Usually, we did the fungus culture by collecting nail samples using a surgical blade, but this procedure showed low positive culture rate. An emery board is a tool used to gently grind down and shape the edges of nails.
Objective: The aim of this study is to compare positive culture rates of nail sampling techniques in diagnosis of onychomycosis using surgical blade and emery board.
Methods: We collected and assessed data of 49 patients in total, with chief complaints of nail problem, and showed positive results in KOH smear. Fungus culture was performed twice in each patient, both by scraping nail with surgical blades and grinding nail piece with emery board. After 4 weeks from culture, we compared positive culture rates of two nail sampling techniques.
Results: In 49 patients, 16 patients were male and the other 33 were female, with average age of 51.4 years. When classified by morphological type, there were 45 cases of distal lateral subungual onychomycosis (DLSO) and 4 cases of white superficial onychomycosis (WSO). Culture using emery board produced 18 positive results (36.7%) out of 49 patients, and that using surgical blade produced 9 positive results (18.4%); the difference were statistically significant. In other words, nail sampling using emery board rather than surgical blade resulted in higher positive culture rate.
Conclusion: Therefore, emery board can be used as a useful device for diagnosis and identification of causative fungi in onychomycosis in clinical practice and a method to enhance positive rates of cultures.
Keywords
Emery board Fungus culture Onychomycosis Surgical blade
서 론
손발톱진균증(onychomycosis)은 피부사상균(dermatophytes), 칸디다, 비피부사상균성 사상균(nondermatophytic moulds, NDM) 등의 진균에 의한 손발톱 감염증을 총칭한다[1]. 전체 손발톱 질환의 약 50%를 차지할 정도로 매우 흔한 질환이며, 최근 고령 인구의 증가, 당뇨병의 높은 유병률 등에 의해 손발톱진균증의 유병률이 증가하고 있다[1],[2]. 손발톱진균증은 손발톱끝아래허물(hyponychium)을 통해 손발톱바닥으로 전염되고, 손발톱판을 파괴 한다.
여러 가지 손발톱 질환에서도 손발톱진균증과 유사한 손발톱의 변형을 보일 수 있고, 장기간의 치료가 필요하기 때문에 진균 감염에 대한 정확한 진단이 필수적이다[3]. 또한 피부사상균 이외의 진균에 의해서 발생한 경우, 균종에 적절한 항진균제를 사용하여야 하므로 감염을 일으킨 균종에 대한 확인이 필요하다[4],[5]. 일반적으로 외래에서 시행할 수 있는 검사로 KOH (potassium hydroxide) 검사와 진균 배양 검사가 있다6. KOH 검사는 양성율이 높다는 장점이 있으나, 진균의 균종을 확인할 수 없다는 단점이 있다. 진균 배양 검사는 균종을 확인할 수 있으나, KOH 검사 등에 비해 양성률이 낮고, 배양시간이 길다[1],[2].
일반적으로 외래에서 진균 배양 검사를 시행할때에는, 15번 수술용 블레이드(Fig. 1A)를 이용하여 손발톱밑(subungual)을 긁어내서 얻은 손발톱판 검체를 모아서 배양한다. 하지만 수술용 블레이드를 통한 조갑하 각질 채취에는 한계가 있다. 에머리보드는 손발톱의 모양을 다듬기 위해 사용되는 도구로, 막대기 모양의 판에 연마제를 붙여놓아 고운 사포 같은 면을 갖고 있어 손발톱을 갈아낼 수 있다(Fig. 1B). 이에 저자들은, 본 연구에서 손발톱진균증 환자들을 대상으로 수술용 블레이드와 에머리보드로 채취한 각 검체의 진균 배양율을 비교하여 손톱 줄(nail file)을 이용한 검체 채취의 효용성을 밝혀내고자 한다.

대상 및 방법
1. 연구 대상
2015년 3월부터 2015년 8월까지 한림대학교성심병원 피부과 외래에서 손발톱의 증상으로 진료를 본 만 18세 이상의 초진 환자들 중, KOH 도말 검사상 양성을 나타낸 환자를 대상으로 하였다. 진균 검사는 70% 알코올로 병변을 소독한 뒤 각질을 채취하였고 10% KOH 용액으로 처리하여 현미경으로 균사 및 포자 유무를 확인하였다. 손발톱진균증은 감염경로와 침범 부위에 따라 보통 Distal and lateral subungual onychomycosis(DLSO), Proximal subungual onychomycosis (PSO),White superficial onychomycosis (WSO), Endonyx onychomycosis (EO), Total dystrophic onychomycosis (TDO) 다섯 가지 형태로 분류되는데 본 연구에서는 가장 흔한 형태의 DLSO와 WSO를 대상으로 삼았고, 검사의 정확성과 편이성을 위해 나머지 아형들은 제외하였다.
2. 연구 방법
1) 설문지 조사 및 배양 전 검사
본 연구는 보다 효과적인 치료를 위해 배양 검사를 통한 균주 확인이 필요함을 설명한 뒤, 환자의 동의를 구한 뒤 시행하였다. 연구 대상으로 선정된 환자들은 진균 배양 검사를 하기 전에, 현재 병력 및 과거력, 복용중인 약물, 이전까지의 치료 시행 여부 등 환자들의 기본 정보에 대한 설문지를 작성하였다. 배양 검사를 하기 전, 병변 부위의 임상 사진 촬영을 시행하였고, 기저 질환의 확인 및 경구약 복용 여부를 확인하기 위해 일반 혈액 검사 및 일반 화학 검사를 시행하였다. 다발성인 경우 침범 부위를 중복하여 모두 표기하고, 침범 부위에 따라 아형(subtype)을 구분하였다.
2) 배양 검사 및 미생물 동정
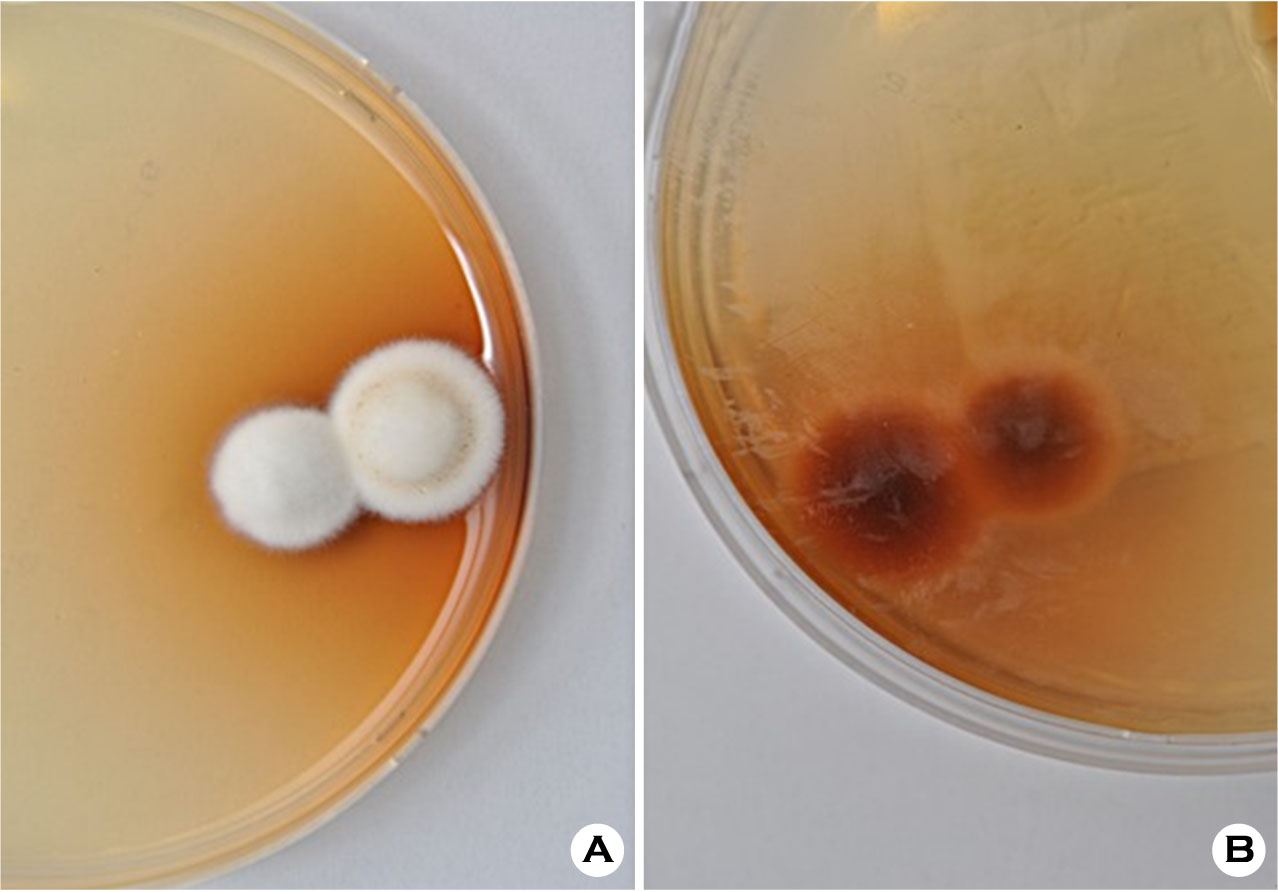
진균 배양은 한 환자당 수술용 블레이드와 에머리보드로 각각 검체를 채취하여 총 2회를 시행하였고, 진균 배양(A), 진균 배양(B) 두 개의 배지로 구분하여 담아 배양하였다. 채취한 검체는 chloramphenicol이 첨가된 Sabouraud's dextrose agar 배지에 접종하고, 26~28℃에서 약 4주 간 배양 후 집락의 육안적 형태 및 현미경적 소견에 따라 균을 동정하였다(Fig. 2A, 2B). 한 부위가 아닌 다발성으로 침범한 경우 임상의의 판단 하에 가장 저명한 부위에서 시행하였고, 검체는 연구 담당의사가 전담하여 쌀알 크기의 양을 채취하였다. DLSO type은 수술용 블레이드의 경우 조갑하 각질을 직접 긁어서 채취하였고, 에머리보드는 손톱깍기(nail clipper)로 조갑원위부를 떼어내고, 떼어낸 조갑 부위를 에머리보드로 갈아서 채취하였다. WSO type의 경우 병변부를 알코올솜으로 닦은 후 표면을 수술용 블레이드로 직접 긁거나, 에머리보드로 표면의 단단한 판을 얇게 갈아낸 뒤채취하였다.
3) 분석
본 연구에서는 자료의 통계적 분석을 위해 IBM SPSS statistics version 22.0 for Windows 통계 프로그램을 이용하였다. 수술용 블레이드와 에머리보드 두 그룹 간의 양성률 비교를 위해 Chisquare test를 하였고, 침범 부위 및 아형별 양성률의 비교를 위해 Fisher's exact test를 시행하였다. 통계적 유의성은 p-value가 0.05 이하인 경우로 정의하였다.
결 과
상기 기간 동안 손발톱 문제를 주소로 내원하여 KOH 검사소견 상 양성을 보인 환자 중 본연구에 동의한 환자는 총 49명이었으며, 이 중 여자는 33명(67%), 남자는 16명(33%)이었다. 연령별로는 60세 이상의 노인이 13명(27%), 60세 미만의 환자가 36명(73%)이었으며, 평균 나이는 51.4세였다(Table 1). 평균 유병 기간은 5년 정도였으며, 내원하기 전 치료를 받은 적이 있는 환자는 30명 (61%), 치료를 받은 적이 없는 환자는 19명(39%) 이었다. 이 치료군들은 보통 1~2가지의 치료를 받았으며, 치료 방법에는 경구 항진균제의 복용 및 연고 혹은 네일라카 형태의 외용 항진균제 도포 등이 있었다. 형태학적으로 분류했을 때, DLSO type이 45명(92%)이었고, 나머지 4명(8%)은 WSO type이었다.손발톱진균증 발생 부위별 분포를 보면 DLSO type은 손가락을 침범한 환자는 6명, 발가락을 침범한 환자는 42명 있었다. 침범된 손가락은 총 9개로 평균 발생 부위는 1.5개였으며, 모두 원위부에 침범한 형태로 나타났다. 발가락의 경우 총 132개로 원위부는 128개, 측위부가 4개였으며, 평균 발생 부위는 3.14개였다. WSO type의 환자들은 4명 모두 발가락만을 침범했으며 침범한 발가락 수는 19개로 평균 발생 부위는 4.75개였다.

Note: the difference between the sets are significant (p=0.042) under 95% significance level.
수술용 블레이드와 에머리보드를 사용한 두 그룹 간의 진균 배양 검사 결과(Table 2)는 총 49명의 환자 중 각각 9명, 18명에서 양성을 보였고, 35명, 29명에서 음성을 나타냈다. 2종 이상의 다양한 균주가 동정된 경우, 오염되었다고 간주하여 검사 결과에서 제외하였다. 배양된 원인균을 살펴보면, T. rubrum이 수술용 블레이드는 6, 에머리보드의 경우 11로 가장 많이 동정되었다.

두 그룹 간의 양성률을 비교해 보면, 총 49명 의 환자 중 수술용 블레이드는 9명이 양성을 보여 18.4%의 양성률을, 에머리보드는 18명이 양성을 보여 36.7%의 양성률을 나타냈으며, Chi-square test 상 카이제곱 값은 4.141, p-value 값은 0.042로 95%의 신뢰구간에서 통계적으로 유의하였다(Table 3). DLSO 그룹 내에서 원위부(distal) 그룹과 측위부(lateral) 그룹으로 나누어 에머리보드를 사용한 진균 배양 검사 결과를 비교하였다(Table 4). DLSO 아형은 총45명이었고, 이 중 원위부 그룹은 42명, 측위부 그룹은 3명이었으며, 각각 16명, 1명이 양성을 보여 양성률은 각각 38.1%, 33.3%을 보였다. 또 DLSO 그룹과 WSO 그룹 간의 비교에서는 DLSO 그룹은 총 45명의 환자 중 17명에서 양성을 보여 37.8%의 양성률을 보였고, WSO그룹은 총 4명의 환자 중 1명의 환자에서 양성을보여 25%의 양성률을 보였다(Table 5).
고 찰
손발톱진균증은 비교적 임상에서 흔히 관찰할 수 있는 질환이며, 표재성 진균 질환의 일종으로, 전체 피부진균증 환자의 30%, 그리고 손발톱 질환의 40~60%를 차지한다[1]. 조갑의 진균 감염에 의해 변색, 비후, 박리 등이 나타나고 건선, 편평태선, 습진 및 외상 등에 의한 조갑 병변과 임상적 감별이 필요하다[2]. 실제로 손발톱 변형의 약 50% 정도만 진균 감염이 원인이며, 따라서 민감하고(sensitive) 효율적인 진단 방법을 통해 정확한 진단을 내리는 것이 중요하다[7]. 손발톱진균증은 한번 발생하면 만성적인 경과를 보이며, 장기간의 치료를 필요로 하는데, 알맞은 치료제를 선택하기 위해서는 원인균을 동정하는 것이 가장 중요하다[4],[5].

현재, 임상에서 흔히 사용하는 검사 방법은 KOH 검사와 진균 배양 검사가 있으며, 병리 조직 검사와 KONCPA (KOH Treated Nail Clippings Stained with PAS) 검사가 소개되면서 진단율을 향상시킬 수 있게 되었다[1]. 손발톱진균증의 진단 양성율은 KOH 검사는 40~60%, 진균 배양 검사는 20~50% 정도이다,[1],[2]. 병리 조직 검사는 병변 부위를 비침습적으로 잘라 조직절편을 제작해 periodic acid-Schiff (PAS) 염색이나 Gomori-Grocott 염색을 시행한 후 관찰하는 데, 양성률이 70~90%로 매우 높다[1]. 임상적으로 손발톱진균증이 의심되지만 KOH 검사와 진균 배양의 결과가 음성으로 나오는 경우 시행해 볼 수 있으며, 진균의 존재 및 침범 정도, 배열을 알 수 있고, 형태를 관찰함으로써 원인균의 구별이 가능하다[1]. KONCPA 검사는 병변부에서 채취한 조갑을 KOH 용액에 넣고 가열하여 용해시킨 후 PAS 염색을 하여 진균 성분을 관찰하는 방법으로, 1993년 Liu 등이 처음으로 소개하였다[1]. 진균 성분만을 모아 관찰함으로써 진균 성분의 다양한 형태를 한 슬라이드에서 관찰할 수 있는 장점이 있으며, 양성률도 70~90%로 높다[1]. 최근에는 중합효소연쇄반응(polymerase chain reaction, PCR)이 사용되기도 하는데, 2~3일내에 소량의 DNA로 진균의 존재 유무 및 동정이 가능한 장점이 있다[1],[2],[8].
Shin 등2은 60명의 환자들을 대상으로 손발톱진균증의 진단에 있어 KOH 검사, 진균 배양 검사, 병리 조직 검사 및 중합효소 연쇄반응의 양성률을 비교하였고, 각각 87.5%, 8.9%, 87.5%, 83.9%로 나타났다. Jung 등[9]의 연구에서도 손발톱진균증의 KOH 검사, 진균 배양 검사, 병리 조직 검사 각각의 단일 검사 양성률은 55.9%, 29.4%, 88.2%로 보고되었다. 진균 배양 검사와 병리 조직 검사를 같이 시행할 경우 양성률이 94.1%로, KOH검사와 진균 배양 검사를 같이 시행한 72.1% 보다 높게 나타났다[9]. 이에 Jung 등[9]은 반복적인 KOH 검사에서도 음성이 나올 경우 손톱깍기(nail clipping)와 PAS 염색을 통한 병리 조직 검사 및 진균배양 검사를 시행하는 새로운 진단적 알고리즘을 제시하기도 하였다. 또, Moon 등[10]이 1991년부터 2000년도까지 7,568명의 환자들을 대상으로 시행한 피부진균증의 임상 및 균학적 관찰 연구에서 손발톱진균증의 KOH 검사 양성률은 40.3%로 평균보다 낮았고, 진균 배양 검사 배양률은 19.4%로 가장 낮았다.
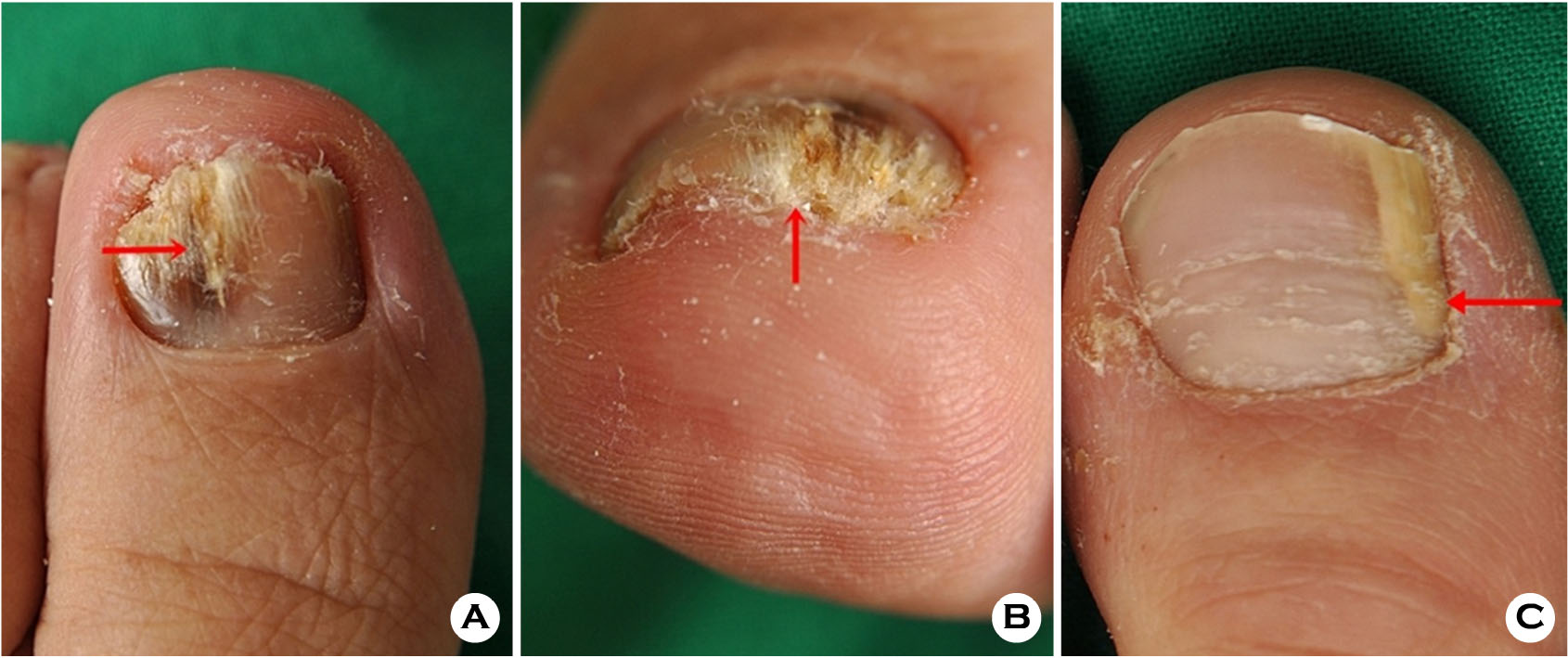
이렇듯 진균 배양 검사는 다른 검사 방법에 비해 양성률은 가장 낮고 오랜 시간이 소요되는 단점을 가진다. 또, 결과값의 큰 변화(variation)를 보이며, 칸디다나 NDM이 배양되거나 잡균 오염이 있는 경우 원인 균주를 밝히는 데 어려움이 있다[3],[11]. 하지만 KOH 검사와 함께 피부과 자체에서 간단히 시행할 수 있고, 원인균을 정확히 알 수 있는 가장 좋은 방법이므로 필수적으로 시행해야할 검사이다. 따라서 진균 배양 검사의 양성률을 높이는 것은 진단적 가치가 있다. 에머리보드는 막대기의 한쪽 면에 고운 사포 같은 것이 붙어 있어, 손발톱을 갈아내어 모양을 다듬는데 사용하는 도구로, 판상 형태의 줄이다. 금속성의 줄은 네일 파일이라고도 하며 주로 네일샵에서 매니큐어나 페디큐어에 이용한다. 본 연구에서 49명의 환자들을 대상으로 한 진균 배양 검사에서, 수술용 블레이드를 이용했을 경우 18.4%, 에머리보드를 이용했을 경우 36.7%의 양성률을 보였고, 기존 문헌 보고와 비슷한 수준으로 나타났다. 보다 정확하고 높은 양성률을 얻기 위해서는 조갑 병변에서 검체를 채취할 때, 적절한 부위에서, 올바른 방법으로 충분한 양을 얻어야 한다. 올바른 검체 채취부위는 손발톱판(nail plate)이 아닌 손발톱 바닥(nail bed)이며, 가능한 한 조갑각피(nail cuticle)에 가까운 부위에서 시행해야 한다(Fig. 3A, 3B, 3C). 이는 진균이 조갑 병변의 근위부에서 증식이 활발하고, 말단으로 갈수록 균사가 죽기 때문이다. 또, 검사 전 병변 부위를 알코올솜으로 닦아 오염균을 제거하는 것이 중요하다. 또 전체 환자의 61%에서 내원하기 전 치료를 받은 경험이 있었고, 따라서 검체 채취 시에는 균이 동정되지 않을 가능성이 있다. 본 연구에서 에머리보드를 사용한 진균 배양 검사에서 수술용 블레이드를 이용했을 때 보다 높은 양성률을 보였는데, 이는 에머리보드가 검체를 좀 더 잘게 갈았기 때문이라고 생각된다. 실제로 이전 문헌 보고에서, Zaias 등[12]은 조갑 병변을 떼어낸 후 분쇄기로 분말을 만들어 접종하였더니, 대조군에 비해 높은 양성률을 보였다. 또, English와 Atkinson[13]은 흡인 장치가 달린 치과용 드릴을 사용하여 검체를 채취하였고, 높은 양성률을 보고하였다. Moon 등[10]의 연구에서 손발톱진균증의 KOH 검사 양성률에 비해 진균 배양검사 양성률이 가장 낮고, 오염도가 가장 높게 나타났는데, 이는 검사자의 기술적인 문제로 생각되며 본 연구에서와 같이 검체를 채취할 때 에머리보드, 손톱 줄 혹은 드릴(drill)을 이용한다면, 배양율을 높일 수 있을 것으로 생각된다.
에머리보드를 사용한 그룹에서, DLSO 군과 WSO 군의 양성률은 각각 37.8%와 25.0%로 DLSO군에서 좀 더 높게 나타났으며, DLSO 군 내에서도, 원위부 그룹이 측위부 그룹에 비해 38.1% 대 33.3%로 높은 양성률을 보였다. 이는 검체 채취방법 및 검체의 양, 검사자의 숙달 정도의 차이 등을 생각해 볼 수 있으며, 손톱의 구조상 측위부가 원위부에 비해 검체 채취가 어려운 것에 기인한 것으로 보인다.
이번 연구의 제한점으로는 단일 연구 기관에서 시행되었으며, 적은 환자 수로 인해 연구 결과가 과대평가 될 수 있다는 점이다. 또, 표본 수가 적어 손발톱진균증의 다양한 아형별 환자들을 모집하지 못했고, 아형별로 그 양성률의 차이를 비교하지 못했다. 이에 대해선 이 후 좀 더 많은 환자군을 대상으로 한 대규모 전향적 혹은 후향적 연구가 필요할 것으로 사료된다.
결 론
저자들은 2015년 3월부터 2015년 8월까지 한림대학교성심병원 피부과 외래에 손발톱의 증상으로 진료 본 만 18세 이상의 초진 환자들 중 KOH 검사에서 양성을 보인 환자들을 대상으로 15번 수술용 블레이드와 에머리보드를 사용한 진균 배양 검사의 양성률을 비교하였다. 총 49명의 환자중 수술용 블레이드는 18.4%인 9명에게서, 에머리보드는 36.7%인 18명에서 진균 배양 검사 양성을 나타내었고, 이러한 차이는 통계적으로 유의하였다. 즉, 진균 배양 검사 시 임상에서 흔히 사용하는 수술용 블레이드보다 에머리보드를 사용하여 검체를 얻었을 때, 그 양성률이 더 높게 나타났다. 본 연구는 에머리보드를 이용한 진균 배양검사의 양성률을 구하고, 기존의 검사 방법과 비교한 첫 연구로, 비록, 단일기관에 내원한 환자를 대상으로 하였고, 그 표본 수가 적다는 제한점이 있으나, 낮은 검사 양성률이 단점인 진균 배양 검사의 양성률을 높이는 방법을 제시했다는 점에서 의의가 있을 것이라고 생각한다. 에머리보드를 이용한 진균 배양 검사는 비침습적이고, 외래에서 손쉽게 시행하고 접할 수 있는 진단 도구로써, 본 연구를 통해 손발톱진균증의 진단과 원인균 동정향상에 도움을 줄 수 있을 것으로 사료된다.
Conflict of interest
In relation to this article, I declare that there is noconflict of interest.
References
1. Cho BK, Kang H, Kim SY, Park YM, Park HJ, Oh ST, et al. Infectious diseases of the nail. In: Diseases of the Nail. Seoul: Seoheung Publishing Co, 2009: 103-122
2. Shin YM, Shin DH, Choi JS, Kim KH, Kim GJ. A comparative study of KOH preparation, fungal culture, histopathologic examination and polymerase chain reaction for diagnosis in onychomycosis. Korean J Med Mycol 2007;12:59-69
Google Scholar
3. Daniel CR. The diagnosis of nail fungal infection.Arch Dermatol 1991;127:1566-1567
Crossref
Google Scholar
4. Kim JW, Ro BI, Houh W. A clinical and mycological study of superficial fungal diseases. Korean J Dermatol 1973;11:139-150
5. Rhim KJ, Kim JH, Shin S. A clinical and mycological study of superficial dermatophytoses. Korean J Dermatol 1978;16:435-442
Google Scholar
6. Weinberg JM, Koestenblatt EK, Tutrone WD, Tishler HR, Najarian L. Comparison of diagnostic methods in the evaluation of onychomycosis. J Am Acad Dermatol 2003;49:193-197
Crossref
Google Scholar
7. Cho BK. Diagnosis and examination of onychomycosis. In: Korean Taskforce on onychomycosis education (K-TOE). Seoul: Seoheung Publishing Co, 2006:33-38
8. Paugam A, L'ollivier C, Viguié C, Anaya L, Mary C, de Ponfilly G, et al. Comparison of real-time PCR with conventional methods to detect dermatophytes in samples from patients with suspected dermatophytosis. J Microbiol Methods 2013;95:218-222
Crossref
Google Scholar
9. Jung MY, Shim JH, Lee JH, Lee JH, Yang JM, Lee DY, et al. Comparison of diagnostic methods for onychomycosis, and proposal of a diagnostic algorithm. Clin Exp Dermatol 2015;40:479-484
Crossref
Google Scholar
10. Moon HJ, Lee JB, Kim SJ, Lee SC, Won YH. Clinical and mycological studies on dermatomycosis (1991-2000). Korean J Med Mycol 2002;7:78-85
Google Scholar
11. Suarez SM, Silvers DN, Scher RK, Pearlstein HH, Auerbach R. Histologic evaluation of nail clippings for diagnosing onychomycosis. Arch Dermatol 1991; 127:1517-1519
Crossref
Google Scholar
12. Zaias N, Oertel I, Elliott DF. Fungi in toe-nails. J Invest Dermatol 1969;55:140-142
13. English MP, Atkinson R. An improved method for the isolation of fungi in onychomycosis. Br J Dermatol 1973;88:237-241
Crossref
Google Scholar